国際獣疫分野
横山 直明教授(兼)
牛ピロプラズマ(タイレリアおよびバベシア)病は,家畜動物に発熱や貧血などの消耗性疾患を引き起こし,世界で深刻な経済的被害をもたらしています。しかしながら,いずれの牛ピロプラズマ病に対しても有効な対策が確立されていません。そこで,その牛ピロプラズマ病に対する制圧法を確立するために,
- 国内外の牛ピロプラズマに関する分子疫学調査による実態把握
- タイレリア媒介マダニの同定とマダニ対策の考案
- タイレリア感染に伴う牛免疫応答の解明とワクチンの開発
- バベシアの赤血球侵入機序の解明とワクチンの開発
- ワクチン候補分子の遺伝子多型とその簡易検出系の確立
- 汚染国に適したオーダーメイド型サブユニットワクチンの確立
などを実施しています。また,牛ピロプラズマ病の問題を抱える海外汚染国から若手研究者を受け入れて,研修と人材育成に努めるとともに,牛ピロプラズマ病の制圧に関する国際的共同研究ネットワークの構築に取り組んでいます。



菅沼 啓輔准教授(兼)
有用なワクチン,安全な治療薬の存在しないトリパノソーマ症の対策を確立するために,様々な角度からトリパノソーマとトリパノソーマ症に関する研究を行っています。
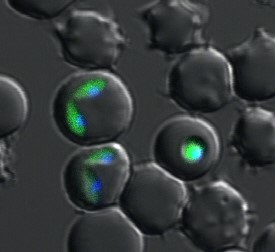
- 発育ステージ変換時における分子機構の解明(図1)
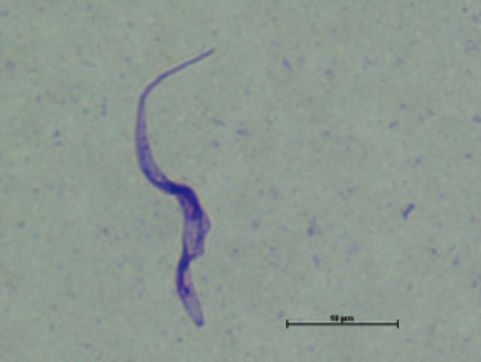
媒介昆虫と宿主哺乳類に寄生して生きるトリパノソーマは,寄生環境の変化に適応するため自身の姿形を大きく変化させる「発育ステージ変換」を行います。発育ステージ変換とそれに伴う遺伝子発現調節機構,とくにRNAとRNA結合蛋白質の相互作用に焦点を合わせて分子生物学的手法で解析し,将来的なトリパノソーマ症対策開発を目指しています。 - トリパノソーマ症のフィールド調査(図2)
トリパノソーマ症流行国での疫学調査およびトリパノソーマの分離培養を通じて,トリパノソーマ感染状況の実態と現地流行株の遺伝子情報を収集しています。集めた情報をもとに,感染流行国でのトリパノソーマ症対策を構築しています。 - 新規トリパノソーマ症治療薬開発
トリパノソーマ培養系をもちいた抗トリパノソーマ活性化合物の探索を進めています。見出した有用化合物はトリパノソーマ感染マウスの治療実験を経て臨床応用を目指しています。さらに抗トリパノソーマ化合物の作用機序を,迅速かつ低コストで推測するアッセイ系の開発も進めています。
国際協力分野
河津 信一郎教授
- マラリア
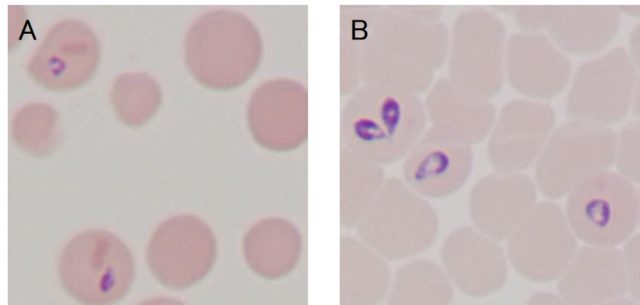
マラリア原虫細胞での,酸化ストレス応答とレドックス(酸化・還元)シグナル,カルシウムシグナルに着目しています。生物は細胞内の酸化・還元バランスやカルシウム振動を利用して,様々な生理機能を調節しています。この仕組みやそこに働く分子の役割を「細胞を観ること」「イメージング実験」に重点を置いて調べています。 - バベシア
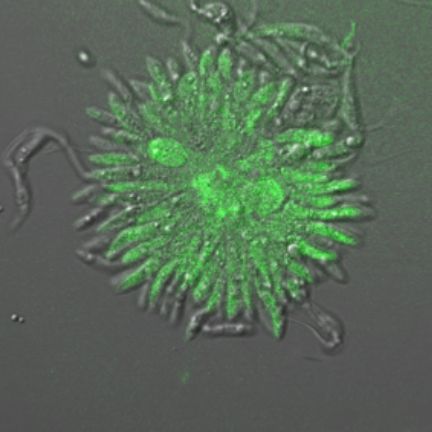
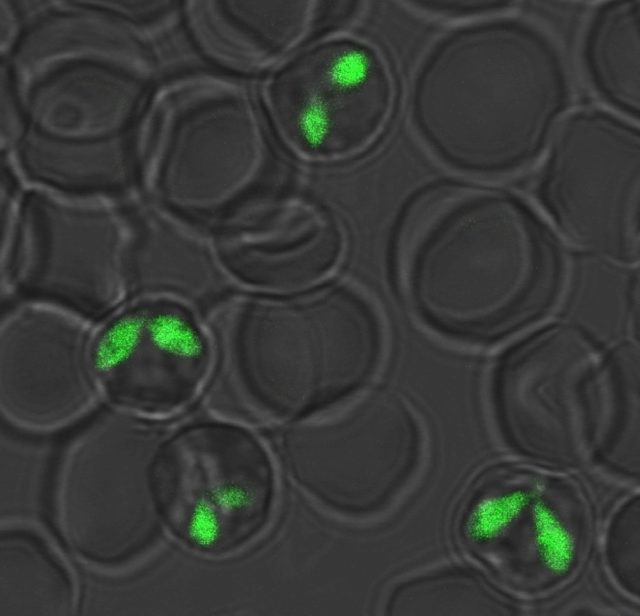
バベシアでの遺伝子操作技術の開発を行っています。これまでに,外来遺伝子発現系(GFP発現原虫)や遺伝子ノックアウト系を開発し,同原虫の赤血球侵入機構や発育機構をライブイメージングによって「目に見える」形で明らかにしていこうとしています。
GFP発現バベシア・ボビス。 - 日本住血吸虫
日本住血吸虫症は,アジア諸国の農村で流行し,農村の保健衛生および家畜衛生と密接に関連した人獣共通感染症です。フィリピンの日本住血吸虫症流行地で,医学・獣医学合同でのOne-Healthアプローチの疫学調査を行っています。また,ヒトおよび動物での同感染症の流行を正確にモニタリングする,ポイント・オブ・ケア・テストの開発など現地に即した簡易診断法の開発研究も行っています。
五十嵐 慎教授(兼)
トキソプラズマは世界人口の2〜3割が不顕性感染している人獣共通感染症です。母子感染による先天性トキソプラズマ症,HIV感染,加齢などによる免疫力の低下で症状が悪化することが大きな問題となっています。当研究室では,トキソプラズマの宿主寄生のメカニズムを解明しようと研究に取り組んでいます。
主な研究課題
- トキソプラズマの宿主細胞寄生メカニズムの解明
トキソプラズマの宿主細胞寄生に関わる分子の同定を試み,新たな薬剤標的分子としての有用性を検討することを目的としています。 - トキソプラズマの急性感染から慢性感染への移行過程の解析
トキソプラズマは急性感染から慢性感染への移行に伴い,その生活環を増殖型からシスト形成型へと変化させます。その機構を明らかにすることにより,ワクチン開発の戦略に役立たせることを目指しています。
井上 昇教授(兼)
地球規模感染症学分野
麻田 正仁 准教授
地球規模で問題となっている原虫病であるバベシア症並びにマラリアを対象に、新規予防・治療法の開発に向け、その赤血球寄生機構の解明を行っています。バベシア、マラリア原虫はアピコンプレクサ門に属する赤血球寄生原虫であり、赤血球寄生ステージにおいて哺乳類宿主に病気を引き起こします。これらの原虫は巧妙なメカニズムで宿主赤血球に侵入し、赤血球内で増殖すると共に、赤血球内での生存の維持や宿主免疫の回避のため、能動的に赤血球の改変を行いますが、その詳細なメカニズムは未だ明らかとなっていません。当研究室では、ゲノム機能解析のための遺伝子改変技術を確立すると共に、イメージング解析やオミクス解析といった手法を組み合わせることで原虫の寄生メカニズムを明らかにしています。
主な研究課題
○ピロプラズマ原虫の宿主赤血球修飾機構の解明
○ピロプラズマ原虫やマラリア原虫の赤血球侵入機構の解明
○偶蹄類マラリア原虫の疫学及び病原性の解明